-
重點(diǎn)浙江eCTD供應(yīng)商
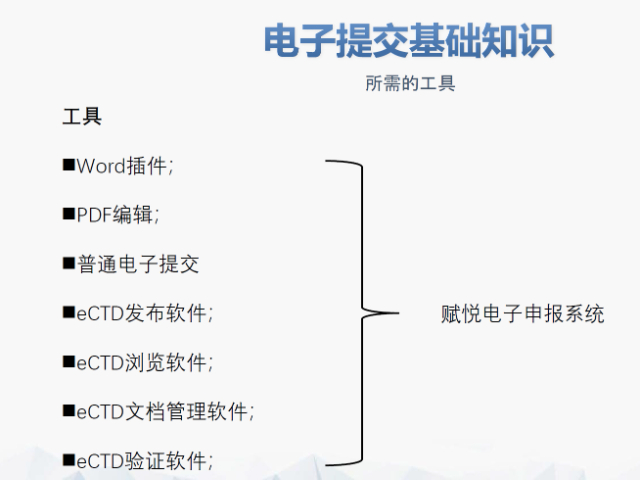
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢
-
重點(diǎn)吳江區(qū)ANDAeCTD軟件
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢
-
重點(diǎn)合肥新藥eCTD服務(wù)電話
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢
-
重點(diǎn)
-
重點(diǎn)上海國(guó)際注冊(cè)eCTD是什么
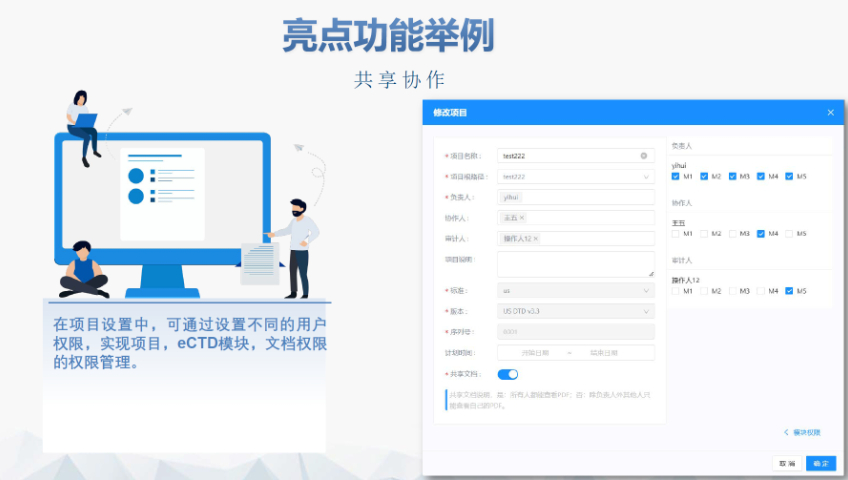
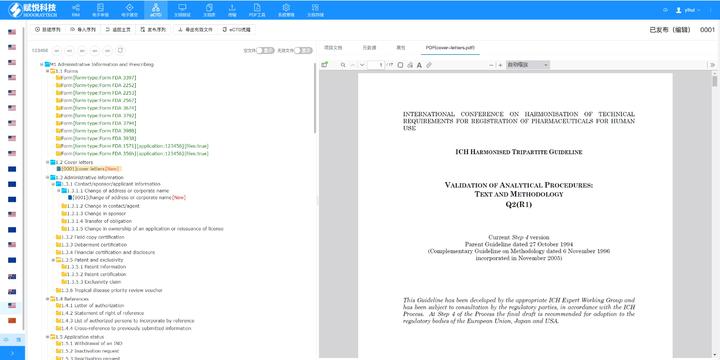
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢
-
重點(diǎn)安徽電子申報(bào)eCTD品牌
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢
-
重點(diǎn)上海NDAeCTD哪個(gè)品牌好
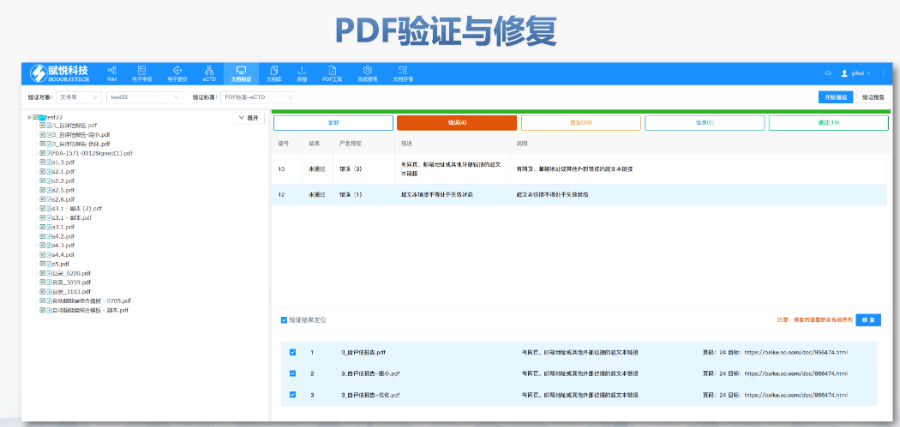
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢
-
重點(diǎn)太倉(cāng)藥品注冊(cè)eCTD系統(tǒng)
主營(yíng)產(chǎn)品: eCTD藥品申報(bào)系統(tǒng)|普通電子申報(bào)系統(tǒng)|eCTD注冊(cè)外包|全球藥品注冊(cè)咨詢